後期臨床開発パイプライン
| 開発品 | 適応症 | 開発ステージ |
|---|---|---|
| ポリ硫酸ペントサンナトリウム(NaPPS) | ムコ多糖症 (ライソゾーム病の1種) |
P2b結果評価中 |
| HTLV-1関連脊髄症 | P2a終了 | |
| 変形性膝関節症 | P2b実施中 | |
| エルトプラジン | パーキンソン病 | P2a終了 |
プロジェクト紹介
ポリ硫酸ペントサンナトリウム(pentosan polysulfate)
ポリ硫酸ペントサンナトリウム(NaPPS)は植物(ヨーロッパブナ)由来の半合成物質で、関節組織への複合的作⽤により変形性膝関節症の症状を緩和します。また、HTLV-1感染T細胞の脊髄内浸潤を抑制して、HTLV-1関連脊髄症(HAM)の下肢機能障害を改善する効果を期待しています。
期待される適応症:変形性膝関節症、ムコ多糖症、HTLV-1関連脊髄症
ムコ多糖症(Mucopolysaccharidoses)
⻑崎⼤学医学部で実施された変形性膝関節症の論⽂発表(注1)を契機として、⽶国マウントサイナイ医科⼤学より、ムコ多糖症動物モデルを⽤いて、ポリ硫酸ペントサンナトリウムのムコ多糖症に対する治療の可能性が提唱されました。(注2)
弊社では、⽶国マウントサイナイ医科⼤学より独占的特許実施権のライセンスを受けて、国内のムコ多糖症研究で中⼼的な役割を担っている先⽣⽅と共に、早期の承認を目指して開発を進めています。
成人T細胞白血病ウイルス(HTLV-1)関連脊髄症 (HAM)
成⼈T細胞⽩⾎病ウイルス(HTLV-1)関連脊髄症 (HAM) は、ヒトレトロウイルスであるHTLV-1感染によって惹起される慢性進⾏性の脊髄炎であり、歩⾏障害、排尿障害等を伴います。2008年に全国的な HTLV-1キャリア及び関連疾患の実態調査が⾏われ、全国の初回献⾎者の抗体陽性者の調査から、全国のキャリア数は約108万⼈と報告され、また、別の報告では、HAMの発症頻度は年間キャリア10万⼈中3⼈、患者数は約3,600⼈と推定されています。治療は、ステロイドやインターフェロンαが⽤いられ ていますが、ステロイドは⻑期投与による副作⽤が認められ、インターフェロンαにも副作⽤の問題が あり、新規の治療法が求められています。
弊社では、JSTのA-STEPを活⽤し、⻑崎⼤学と共同で、ポリ硫酸ペントサンの新規HAM治療薬開発に向けた臨床研究を実施し、ポリ硫酸ペントサンナトリウムがHTLV-1感染T細胞の脊髄内浸潤を抑制して、脊髄内の慢性炎症を抑え、下肢機能障害を改善する可能性を確認しました。現在、これらの結果をもとに、薬剤の承認に向けた臨床試験を計画しています。
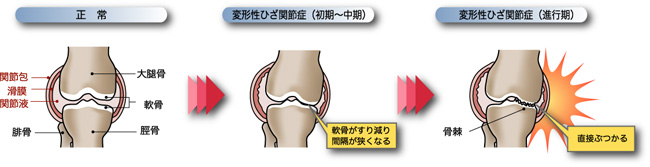
変形性膝関節症(Osteoarthritis)
変形性関節症とは、関節のクッションである軟⾻のすり減りや筋⼒の低下が要因となり、関節に局所的炎症が起きたり、関節が変形した結果、疼痛、圧痛、可動域制限、⽔腫などが⽣じる疾患で、膝関節の他、股関節や手関節(指の第一関節)に発症します。特に、中⾼年の⽅に多い病気で、東京⼤学22世紀センターの疫学調査では、50歳以上で⼥性の約75%、男性の約53%が変形性膝関節症と診断され、潜在的患者数は約3,000万⼈と言われています。進行性の疾患で、重症化した関節を元の状態に戻すことは困難ですが、早期に治療介入することにより、普通に⽇常⽣活を送れることが期待されます。また、重症化してしまった後でも、その時点から治療介入することにより、それ以上の進⾏を遅らせることが出来ます。
ポリ硫酸ペントサンナトリウムは、ドイツのbene pharmaChem GmbH & Co. KGが製造する医薬品で、欧州で最初に抗凝固剤(⾎液を固まらせないようにする薬)、間歇性跛⾏治療剤として開発され、その後⽶国で間質性膀胱炎(疼痛性膀胱症候群)の治療剤として承認・販売されました。⼀⽅、国内では、⻑崎⼤学医学部の丹⽻正美教授(当時)を中⼼とするペントサン研究会が実施した臨床研究を含む幾つかの臨床研究により、本剤がさらに慢性膝関節症に有効であることが⽰されました。(注1)
弊社では、bene pharmaChem GmbH & Co. KGと本剤の共同開発を開始し、変形性膝関節症の適応取得を目指した国内のP1試験、P2a試験を実施したのち、現在P2b試験を実施中です。
(治験の詳細は臨床研究等提出・公開システム (niph.go.jp) をご参照ください。)
注1:K. Kumagai; Clin Pharm 10: 7 (2010)
注2:E. H. Schuchman; Plos One, vol 8, issue 1, e54459 (2013)
エルトプラジン(eltoprazine)
エルトプラジンは5HT1A/1B(注1)のパーシャルアゴニスト(注2)で中枢性疾患の動物モデルで有効性が確認されており、以下の適応症に対して開発が進められております。
| 期待される適応症: | パーキンソン病に伴うジスキネジア |
注1:5HT1A/1Bとは体内で重要な役割をしている神経伝達物質のひとつであるセロトニンが結合する受容体のサブタイプです。
注2:パーシャルアゴニストとは、受容体を完全に遮断するのではなく、生体反応を少しだけ残すように作用する拮抗作用を有する物質のことです。
パーキンソン病に伴うジスキネジア(不随意運動)(Dyskinesia associated with Parkinson disease)
パーキンソン病は中脳⿊質のドパミン神経細胞が変性脱落することによって起こる進⾏性の神経変性疾患であり、ドパミンの放出量が減少し、振戦(震え)、固縮、無動、姿勢反射異常(姿勢障害)などの 症状が出現し、徐々に運動障害が進⾏する疾患です。⽇本での有病率は0.1〜0.15%です。ジスキネジアとは、⾃分では⽌められない、または⽌めてもすぐに出現する制御不能な動きをまとめた呼び名で、パー キンソン病が進展し、レボドパ (L-DOPA) 療法で適切なドパミン放出が出来なくなったことで起きます。このような運動症状の変動 (motor fluctuation) はレボドパ治療開始5-10年 後の患者の半数以上に起こり、罹患年数が⻑くなるほど、ジスキネジアを起こす患者の割合は⾼くなります。
セロトニンが、パーキンソン病のL-DOPA治療に伴うジスキネジアに関与していることが既に報告されており(注3、注4)、さらに本剤においても動物試験にて、L-DOPA誘発のジスキネジアを抑制することが確認されました。マイケル J. フォックス⽒が設⽴したパーキンソン病の患者団体The Michael
J. Fox Foundationの助成⾦で、ヒトにおける有効性を確認する試験(POC試験)を実施しました。
注3: Carta et al., Brain 130: 1819-1833, 2007
注4: Carta et al., Brain 132: 319-335, 2009,/p>